Studie zum Post-COVID-Syndrom
Evaluation einer antiviralen Therapie bei Patient:innen mit dem Post-COVID-Syndrom
Randomized Adaptive Assesssment of post COVID syndrome treatments_Reducing Inflammatory Activity in patients with post COVID syndrome (RAPID_REVIVE)
Die Studie RAPID_REVIVE untersucht, ob eine medikamentöse Behandlung mit einem bisher noch nicht zugelassenen Medikament einen positiven Einfluss auf die Entwicklung des Post-COVID-Syndroms hat.
Es wurden bereits so viele Patient:innen an allen Standorten in die Studie eingeschlossen, dass derzeit keine weiteren rekrutiert werden können.
Sollte die Rekrutierung zu einem späteren Zeitpunkt wieder aufgenommen werden, finden Sie Hinweise auf dieser Website.
Die Mehrheit der Patient:innen erholt sich von einer COVID-19-Infektion ohne bleibende Beeinträchtigungen, aber ein erheblicher Teil leidet unter Langzeitfolgen, die als Post-COVID-Syndrom bezeichnet werden. Diese Menschen haben über Monate hinweg Beschwerden. Die Beschwerden können sehr unterschiedlich sein, und die Ursachen sind noch nicht vollständig verstanden. Die Symptome reichen von Atemnot, Geruchs- und Geschmacksstörungen sowie Müdigkeit, eingeschränkter Belastbarkeit, Muskel-, Kopf- und Gelenkschmerzen bis hin zu kognitiven Störungen, Depressionen und Angstzuständen. Der Schweregrad der Symptome kann von nur begrenzten Beeinträchtigungen im privaten und beruflichen Umfeld bis hin zu völliger Arbeitsunfähigkeit mit einer deutlich reduzierten Lebensqualität reichen. Bislang gibt es keine zugelassene Therapie und es werden lediglich die verschiedenen Symptome behandelt.
Die Studie RAPID_REVIVE untersucht, ob eine medikamentöse Behandlung mit einem bisher noch nicht zugelassenen Medikament einen positiven Einfluss auf die Entwicklung des Post-COVID-Syndroms hat. Hierfür wird im Rahmen der Studie das neue Medikament mit einem Scheinmedikament (Placebo) verglichen.
Alter: mindestens 18 Jahre
Teilnehmen können Patient:innen, die seit mehr als 12 Wochen bestehende Post COVID Symptome aufweisen.
Weitere Teilnahmevoraussetzungen:
- Mäßige bis schwere körperliche Einschränkung
- Es müssen mindestens 2 der folgenden Post-COVID-Symptome zutreffen:
- Fatigue (Erschöpfung)
- Kognitive Beeinträchtigung
- Kurzatmigkeit
- Orthostatische/autonome Dysfunktion (Blutdruckabfall in aufrechten Positionen)
- Fähigkeit, die Art der Studie und die damit verbundenen Abläufe zu verstehen und diesen folgen zu können
- Fähigkeit, ein Smartphone (oder Tablet) bereitzustellen und zur Installation der Software zu verwenden
- Korrekte und konsequente Anwendung einer hochwirksamen Verhütungsmethode während der Studie
Es gibt noch weitere Teilnahmevoraussetzungen, welche in einem persönlichen Gespräch zwischen ärztlichem Personal und den Patient:innen erläutert werden. Eine mögliche Studienteilnahme muss vorab immer durch das ärztliche Personal geprüft werden.
Erfahrungen haben gezeigt, dass die maximale Entfernung zwischen Wohnort und Prüfzentrum nicht mehr als 50 KM betragen sollte, da die Patient:innen während der Studienteilnahme mehrmals für die Visiten in das Prüfzentrum kommen müssen.
Ablauf der Studie
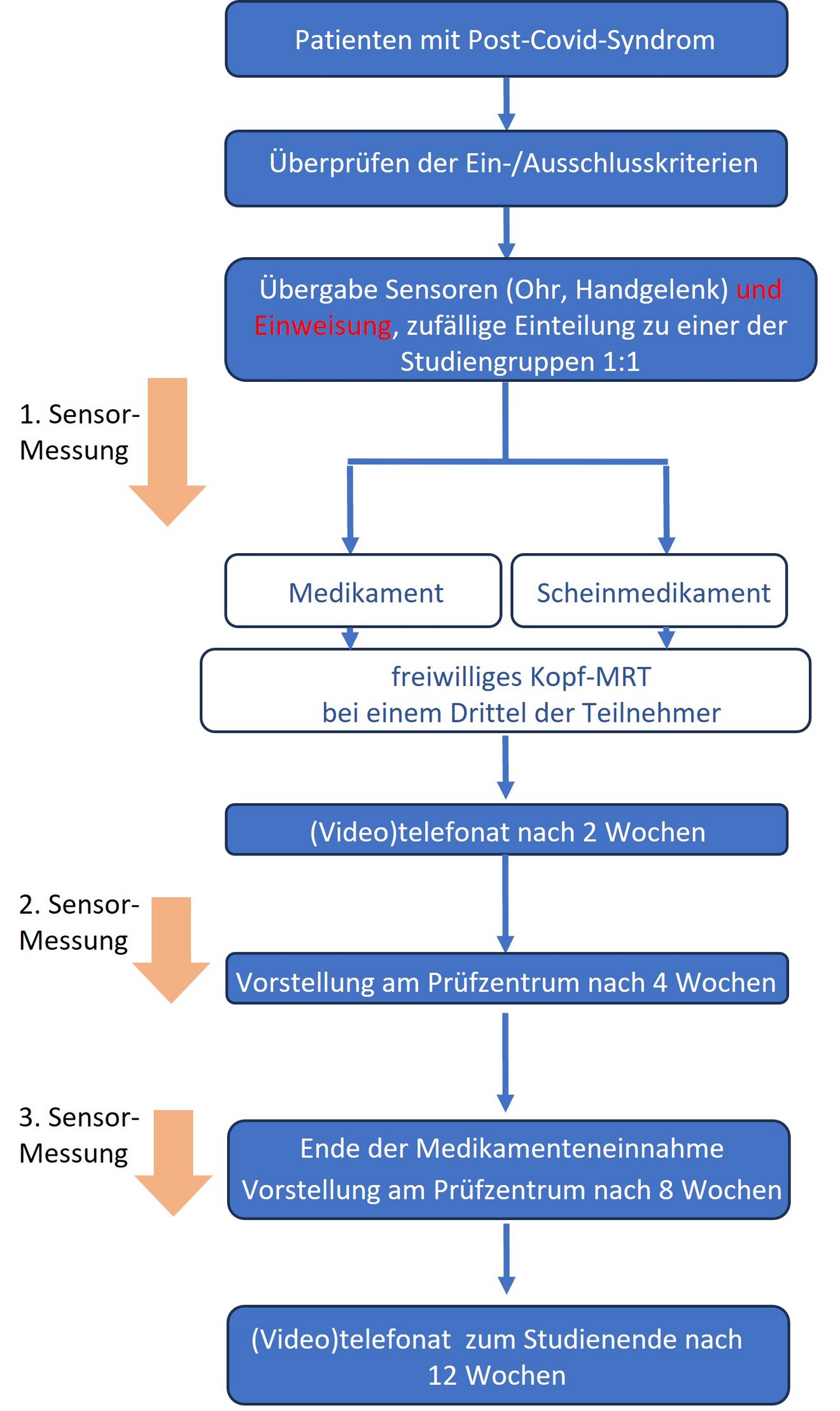
Nach dem Zufallsprinzip werden die Patient:innen einer der beiden Studiengruppen (Medikament / Scheinmedikament) zugeordnet. Eine Gruppe erhält die medikamentöse Behandlung mit dem neuen Medikament, die andere Gruppe erhält ein Scheinmedikament (Placebo) ohne einen Wirkstoff. Weder das ärztliche noch das pflegerische Studienpersonal weiß, welche Patient:innen das Medikament und welche das Placebo erhalten.
Bei beiden Gruppen werden Informationen zur körperlichen und kognitiven Verfassung über Fragebögen gesammelt. Außerdem werden Messdaten/ Vitalparameter (z.B. Sauerstoffsättigung im Blut oder Pulsschlag) über Hilfsmittel (Smartwatch und Ohrsensor) aufgezeichnet.
Die Teilnahme an der Studie dauert etwa 3 Monate. Insgesamt finden 5 persönliche Vorstellungen am Prüfzentrum statt. In dieser Zeit nehmen die Teilnehmenden 56 Tage lang täglich eine Tablette ein. Zwei Wochen nach Einnahmestart findet ein (Video)telefonat mit dem ärztlichen Personal des Prüfzentrums statt.
Anschließend werden zwei persönliche Vorstellungen, nach 4 bzw. 8. Wochen, am Prüfzentrum durchgeführt. Bei den Besuchen am Prüfzentrum finden unter anderem ärztliche Kontrolluntersuchungen, die Erfassung von Fragebögen, Blut- und Stuhlentnahmen und auch Ausgabe der Studienmedikation statt. 4 Wochen nach der letzten Tabletteneinnahme erfolgt ein abschließendes (Video-)telefonat.
Die Nutzung aller in der Studie erhobenen Daten und Biomaterialien unterliegt strengsten Datenschutzrichtlinien. Jede Sammlung von Daten und Bioproben wurde von einer unabhängigen medizinischen Ethikkommission befürwortet. Alle Daten in der Studie, die Personen identifizierend sind (Name, Geburtsdatum, Anschrift etc.) werden verschlüsselt. Einzelne Patient:innen sind damit nicht unmittelbar identifizierbar. Alle Daten unterliegen der Datenschutz-Grundverordnung.
Für alle Teilnehmer:innen einer klinischen Prüfung eines Arzneimittels wird außerdem eine Probandenversicherung abgeschlossen.
Dieser Text richtet sich an medizinisches Personal.